5月15日,做为亨廷顿舞蹈症患者社群的代表,风信子工作团队参与了罗氏的患者参与临床研究知识专题培训活动,学习了临床研究基础知识、临床试验流程及法律法规、患者参与临床试验的方式、受试者权益保护等方面的知识,收获非常多~

一、罗氏医学部患者合作团队吴云女士开场致辞。吴女士介绍罗氏开展的工作不仅有临床试验,在药物可及性等方面,表示会充分考虑患者的心声,同时充分肯定了患者组织的价值,如在疫情中协助供药、心理辅导等服务开展,在医务工作者、药物研发等各方之间都起着桥梁的作用。
罗氏希望能帮助患者组织发展,患者组织赋能工作是长远持续的工作,罗氏希望能与各方保持长期合作关系,做一些有利于患者的事情。
三、复旦儿科李西华主任以“临床试验离我们有多远”为主题,从介绍DMD、BMD、SMA等几种威胁儿童成长发育的疾病,到作为罕见病临床医生,他们是怎么去开展工作的,举例介绍了几例痛心的案例,罕见病患儿家长无法接受孩子患病的事实,又无药可医,产生很大的心理负担,出现焦虑、恐惧、绝望等消极情绪甚至产生自杀想法,李主任表示作为临床工作者在面对这类家长时的困难境地。
李主任还讲述了临床研究是以疾病的诊断、治疗、预后、病因和预防为主要要就内容的,以患者为主要研究对象,以医疗服务机构为主要研究基地,由多学科人员共同参与组织实施的科学研究活动,临床研究是成为临床试验的一部分。


在该不该参与临床试验的问题上,李主任例举了几个大家的疑问,阐述了临床试验的利弊。
对于患者有利因素包括:1.有机会使用最新的治疗方法;2.能得到先进的医疗团队无微不至的关照;3.通过积极参与能及时了解自己的病况;4.减少医疗费用,得到差旅费补助或者全部报销;5.能够帮助他人,推进医学的进步;6.在临床试验中进退自由。

利因素有副作用的影响,随访次数频繁,需要抽血,还有可能被随机分到安慰组等。
四、罗氏产品开发中心张巍峰先生介绍临床试验基础知识。从临床试验的发展历史讲到了临床试验的参与方包括了申报方、研究者、受试者及监管方四个对象。介绍了临床实验的分期和多种方法来减少偏倚、入排标准等几个方面。
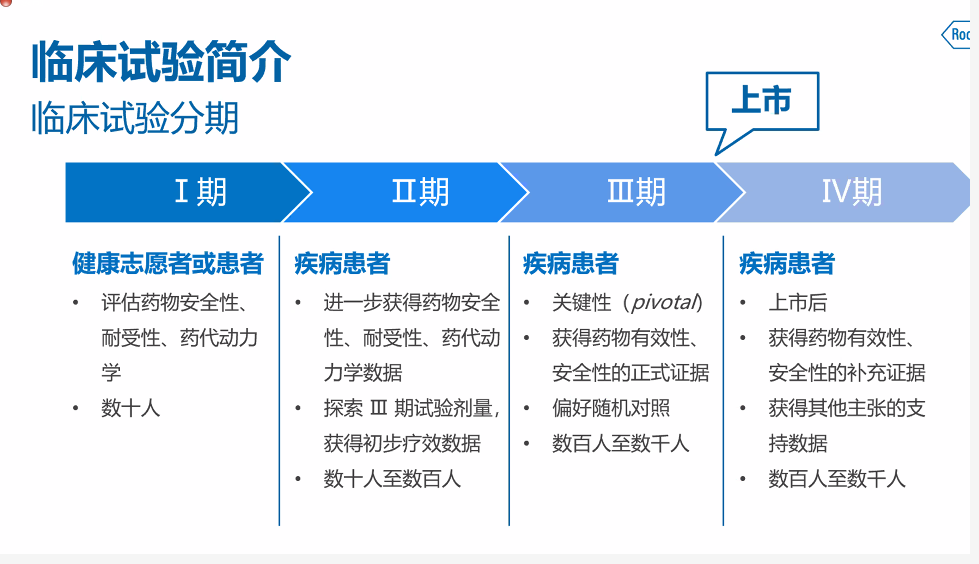
临床实验的分期;一期主要受试者为健康志愿者或患者,去评估药物安全性、耐受性、药代动力学等,人数在数十人的规模。
临床试验二期主要以疾病患者为受试者,进一步探索评估药物安全性、耐受性、药代动力学数据,并增加受试人数至数百人。
三期作为临床试验的关键阶段,为上市做准备的重要一步,主要以疾病患者为受试者,来获得药物有效性、安全性的正式数据,进行随机对照,规模可达到百人至数千人。
第四期主要在药物上市后去评估药物有效性和安全性的补充证据。
张巍峰着重介绍了临床试验的入排标准,解释设定入排标准主要是为了试验的安全及减少试验的偏倚,以及入排标准的统计学意义、临床意义等需要。主要包括纳入标准和排除标准,并以亨廷顿舞蹈症(3期)的临床试验举例。
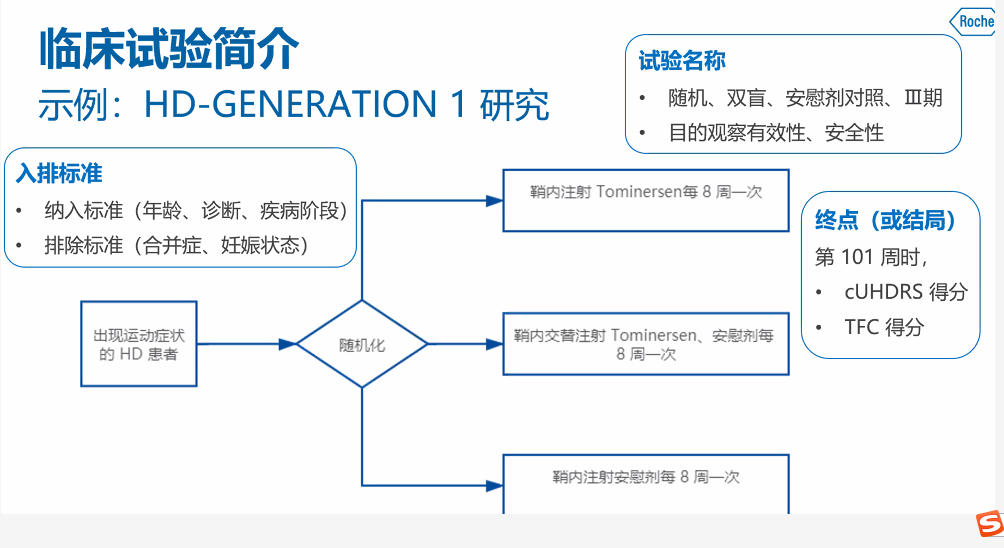
针对出现运动症状的HD患者,随机分组,分别在一组受试者中每8周鞘内注射Tominersen 1次,一组受试者每8周交替鞘内注射Tominersen、安慰剂1次,一组每8周鞘内注射安慰剂1次,在101周时,研究受试者的两个HD的评估量表(cUHDRS、TFC)得分。
同时,张老师重申临床试验的利与弊,并介绍了从申办者的角度在研究方案、知情同意、不良反应应对措施、急救治疗等方面来保护受试者。


张巍峰分享了寻找临床试验资源的几个重要途径:
1.美国国立卫生研究院临床试验注册网站
https://clincaltrials.gov (全面,但是是全英文)。
2.中国药物临床试验登记与信息公示平台
https://www.chinadrugtrials.org
3.罗氏 https://forpatients.roche.com
五、上海新华医院药物临床试验办公室主任沈伟讲解临床试验相关法律法规、相关监管机构职责、新药上市申请流程等。
申明所有临床试验的基础是保护参与临床试验的受试者,为了保护受试者,国家出台了很多的法律法规,不断更新法律法规是为了规范申办方合法合规的开展临床试验。
如《药物临床试验质量管理规范》(2020年7月1日起实施)、《药品注册管理办法》(2020年7月1日起实施)、《中华人民共和国药品管理法》等。
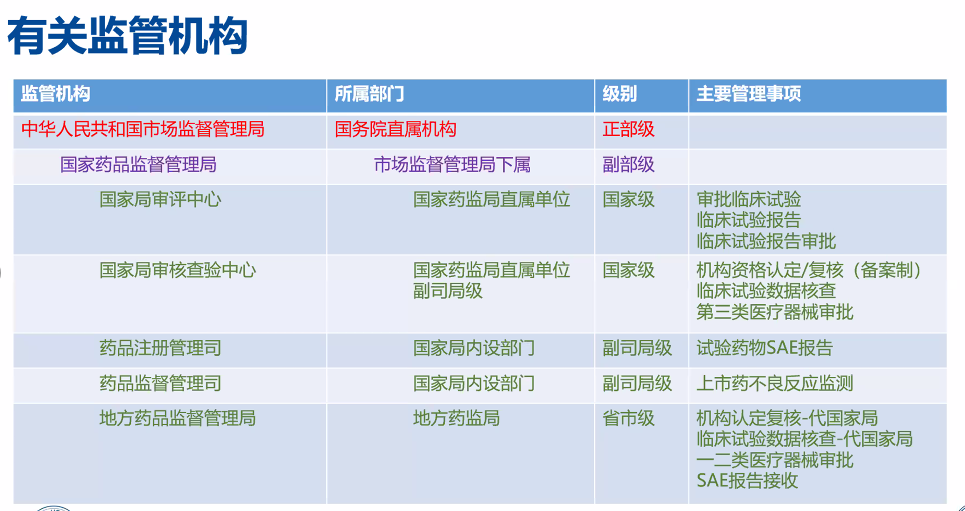
同时,国家出台鼓励药品创新实行优先审评审批政策,如在境外上市的创新药、罕见病药物等。同时,临床试验开展前也必须经过中国个人类遗传资源管理办公室的审核,同时要受到中华人民共和国市场监督管理局、国家药品监督管理局等国家多个部门的监督管理。
六、淋巴瘤创始人顾洪飞讲解临床试验参与方、患者组织定位与贡献、与患者沟通、推荐实验组的准备工作及自己所在组织的合作案例等。
顾先生认为患者组织应该是患者和试验组的协调方和配合方,为优化临床试验设计及加速临床研究做贡献的。顾先生着重介绍了作为患者组织与患者沟通临床试验的注意事项,更全面的了解药物临床试验的过程,更好地保护患者的权益。
在与患者沟通时主要澄清患者组织是谁,能为患者做什么的问题,不能做任何诱导患者做临床试验的事情。
在讲解推荐实验组的准备工作过程中,顾先生强调了组织与申办方在试验内容和设计等方面签订保密协议,并参与试验方案学习讨论,比如入排标准的讨论,去优化方案设计等。
患者组织在发布招募信息的时候一定要保持客观性,可以直接转载申办方的资料或者伦理委员会等的相关资料。
七、上海市第一人民医院伦理办公室主任江一峰讲解临床试验的伦理规范。
从伦理规范的历史沿革讲述为什么临床试验要讲伦理,讲述伦理委员会运作中监督、审查、咨询的功能以及伦理审查的形式和内容、伦理跟踪等,伦理委员会在保护受试者的权益的各种方式。

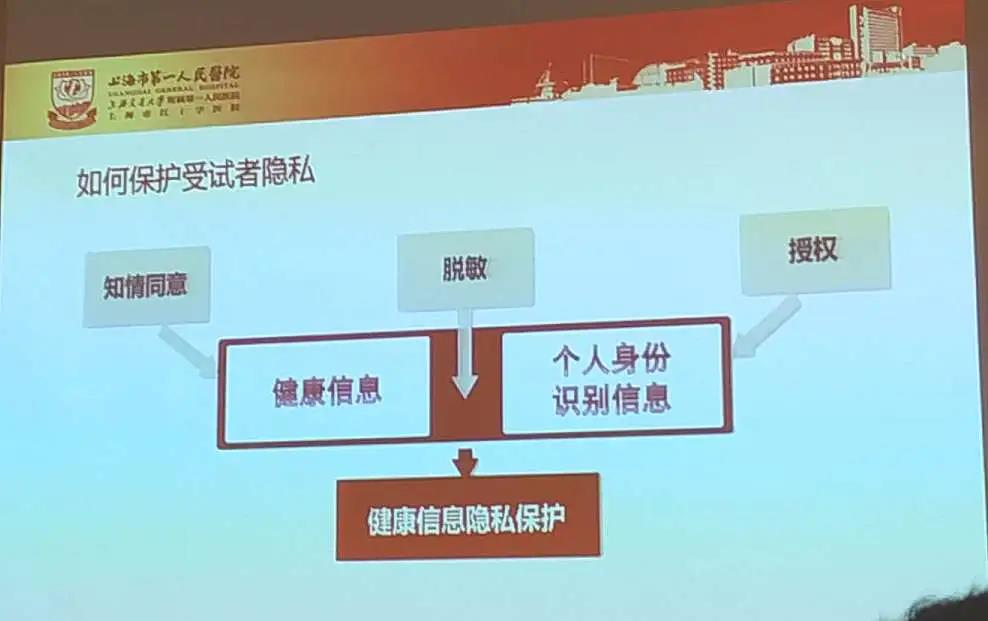
江一峰主任还讲述了临床试验中知情同意环节的重要性和流程及方式,以及伦理委员会对知情同意的要求,强调了临床试验中保护受试者隐私的重要性并对建议可以用脱敏方法(名字拼音、编号等)等方式进行患者隐私保护,以及通过授权的方式把患者信息提供给国家食药监局、伦理委员会等必要了解患者信息的单位等。
八、北京市美儿脊髓性肌萎缩症关爱中心邢焕萍针对临床试验开展过程中如何与患者有效沟通进行分享。
分别从没有临床试验时患者登记工作,开始知道试验消息时科普宣传工作,开放报名时协助医生做招募、答疑工作,入组筛选时协助医生答疑及辟谣工作,入组招募结束后对没有入组的患者家庭进行安抚及协助入组家庭与医生研究团队、药厂之间的沟通交流工作等做了详细讲解。

在临床试验科普工作中坚持按照公示的临床试验信息进行,与研究者沟通的基本原则。针对患者家庭的常见问题做答疑的时候,要与医生及研究团队口径一致,不能代替医生发布通知,同时也要从便捷患者的角度去跟医生团队商量建议关于挂号、检查的等的改善方式。
编者按:临床试验是一个非常复杂的过程,有很多的阶段需要完成,在每个阶段都有明确的目标需要达到,才能进展到下一步。这个过程中,有很多部门、团队和人员的参与,来保障参与临床试验的患者的权益和临床试验的顺利进行。
通讯员:娅玲
风信子关爱
风信子亨廷顿舞蹈症关爱中心是一家致力于为亨廷顿舞蹈症患者提供支持的公益组织。机构创始人来自亨廷顿舞蹈症家庭,机构旨在为亨廷顿舞蹈症患者和家属们提供支持和帮助、倡导积极健康的生活态度、改善患者生活质量。 机构的战略目标是结合社会资源,为全国亨廷顿舞蹈症患者群体发声、提供支持和帮助,改善医疗环境,提升患者及其家庭的生活质量。机构使命是在包容的社会环境下,给患者群体带来有尊严、有质量的生活。